Genoma umano | Cariplo e Telethon finanziano ricerca con partecipazione Unife sulle mutazioni TIMM50
Scienza, cultura e ricerca

Studiare un nuovo meccanismo alla base dell'aciduria 3-metilglutaconica (3-MGA) di tipo 9 (MGCA9), una malattia genetica rara, caratterizzata da ritardi nello sviluppo e disabilità intellettiva, per la quale oggi esistono ancora poche opzioni di trattamento disponibili. Questo l’obiettivo del progetto presentato dal Professor Massimo Bonora del Dipartimento di Scienze Mediche dell’Università degli Studi di Ferrara e dal collega Saverio Marchi dell’Università Politecnica delle Marche, che ha ottenuto il finanziamento dalle Fondazioni Cariplo e Telethon per la ricerca nell’ambito di genoma umano e malattie rare.
L’aciduria 3-metilglutaconica di tipo 9 è un disturbo congenito del metabolismo che provoca accumulo di sostanze acide solitamente tossiche nell’organismo. Si caratterizza in particolare da crisi epilettiche precoci, ritardo dello sviluppo psicomotorio, disabilità intellettiva, riduzione del tono muscolare o spasticità. Al momento non esiste una cura risolutiva, ma si può tuttavia cercare di intervenire sui sintomi con terapie che possono migliorare la qualità della vita dei pazienti.
Si tratta di una malattia mitocondriale che si trasmette per via ereditaria, ma in modo particolare: perché la patologia si manifesti, entrambi i genitori devono essere portatori – anche sani – del gene coinvolto (il gene TIMM50). C'è una probabilità su quattro che ogni figlio erediti entrambi i geni difettosi e sviluppi la MGCA9, mentre invece i portatori sani non hanno sintomi e possono vivere una vita normale.
“I mitocondri sono le ‘centrali energetiche’ delle cellule e ospitano circa 1500 proteine – con una vasta gamma di funzioni – che per la quasi totalità necessitano di essere importate all’interno di questi organelli attraverso un sistema di trasporto molto sofisticato”, spiega il Professor Massimo Bonora. “Le alterazioni di questo sistema di trasporto sono dovute a mutazioni in uno o più geni e causano numerosi disturbi mitocondriali, tra cui l'aciduria 3-metilglutaconica (3-MGA) di tipo 9 (MGCA9), che nello specifico risulta essere associata a mutazioni nel gene TIMM50.”
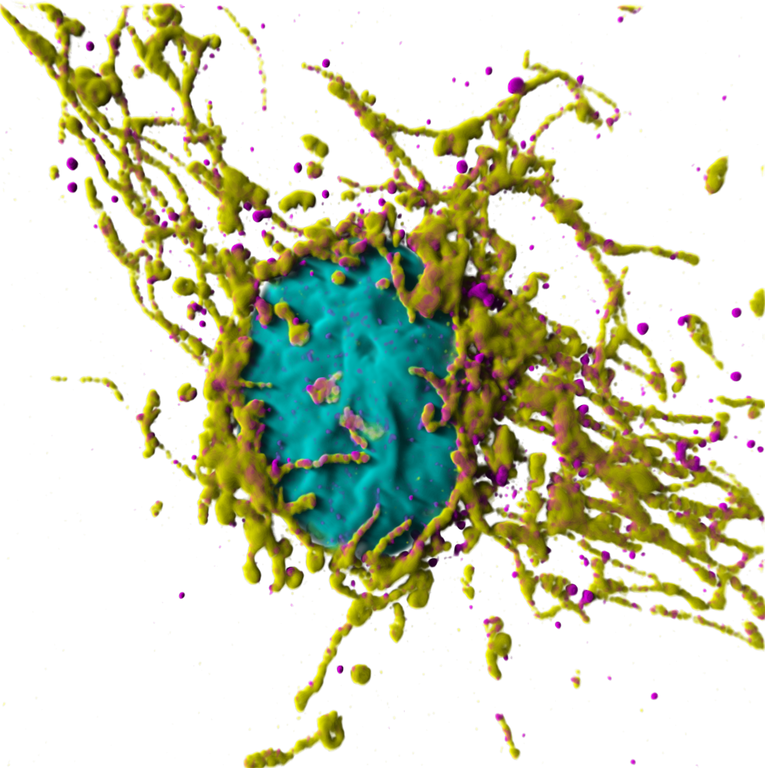
La porta d’ingresso per i mitocondri: una cellula di fegato umana in cui sono stati colorati il DNA (azzurro, contenuto all’interno del nucleo) e i mitocondri (in giallo). La proteina TIMM50 (magenta), il cui gene è associato alla aciduria 3-metilglutaconica (3-MGA) di tipo 9 (MGCA9), è il sito d'ingresso per tutte le proteine codificate dal DNA nucleare e che devono essere trasportate all’interno dei mitocondri.
“Con questo progetto vogliamo far luce su una proteina poco studiata, chiamata CCDC58: quando il sistema di trasporto è compromesso dalla mutazione di TIMM50, abbiamo infatti osservato sia alti livelli di questa proteina, sia drastici difetti mitocondriali, simili a quelli osservati nelle cellule dei pazienti con MGCA9. Crediamo che gli effetti di CCDC58 potrebbero essere associati alla regolazione di un canale mitocondriale (mPTP), la cui attivazione è cruciale nell'innescare alterazioni mitocondriali e morte cellulare. Il legame tra CCDC58 e la funzioni del canale mPTP potrebbe quindi essere coinvolto nella malattia di MGCA9. Esistono farmaci già in uso che possono regolare la funzione di mPTP, ma che non vengono utilizzati a questo scopo. Lo studio valuterà la possibilità di riposizionare questi farmaci ed eventualmente portare al rapido sviluppo di nuove terapie per il trattamento di questa malattia rara.”
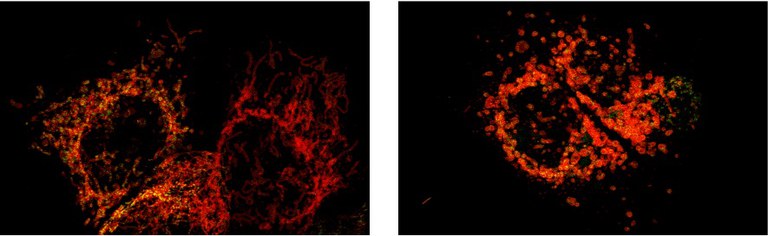
Alcuni cheratinociti umani (cellule della pelle) in cui sono stati colorati i mitocondri (in rosso) ed il DNA mitocondriale (in verde). Nell’immagine a sinistra sono rappresentate delle cellule sane in cui il canale mPTP è chiuso ed il DNA mitocondriale rimane racchiuso all’interno dei mitocondri. Nell’immagine a destra alcune cellule in cui il canale mPTP è stato aperto artificialmente. L’apertura di mPTP causa un profondo stress nei mitocondri che cambiano forma (da
filamentosa a circolare), si rigonfiano e rilasciano il loro contenuto all’esterno diventando difatti disfunzionali.
Giunto alla terza edizione, il bando di Fondazione Cariplo e Fondazione Telethon ha portato alla selezione di 14 nuovi progetti di ricerca, per un totale di 3,2 milioni di euro e di 22 gruppi di ricerca coinvolti. Quello presentato da Unife e Università Politecnica delle Marche fa parte dei 4 che hanno meritato un finanziamento in Emilia-Romagna, per un investimento complessivo di 700mila euro.
L’iniziativa mira a “illuminare la porzione più oscura del genoma umano”, invitando i ricercatori e le ricercatrici a studiare aspetti genetici e meccanismi molecolari ancora in gran parte sconosciuti o scarsamente compresi, ma che rappresentano un potenziale per lo sviluppo di nuove terapie per le malattie rare.
Per saperne di più
Il titolo del progetto è “Caratterizzazione funzionale della proteina mitocondriale CCDC58 e suo ruolo nell’aciduria 3-metilglutaconica di tipo 9”.
